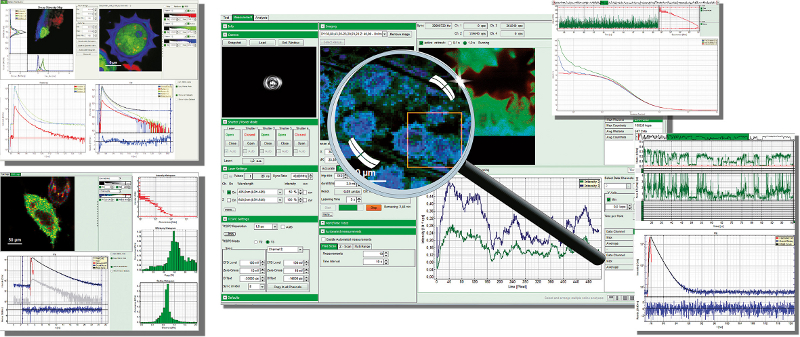
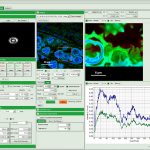
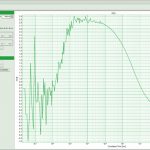
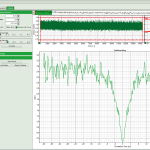
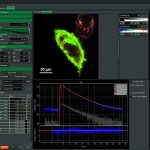
Программный пакет PicoQuant SymPhoTime 64
Программный пакет SymPhoTime 64 представляет собой интегрированное решение для сбора и анализа данных с использованием конфокальных микроскопов PicoQuant с разрешением по времени MicroTime 200, MicroTime 100, комплектов для модернизации LSM или электроники TCSPC.
Fluorescence Lifetime Imaging and Correlation Software
- Мощное 64-битное программное обеспечение для сбора и анализа данных TTTR;
- Точечный, 2D и 3D сбор данных с предварительным просмотром гистограмм FLIM, FCS, временных трасс или TCSPC;
- FLIM, fast FLIM, FLIM-FRET;
- FCS, FCCS, FLCS, PIE-FCS, корреляция совпадений, общая корреляция;
- FRET, PIE-FRET;
- Анализ времени жизни флуоресценции, анализ "burst" одной молекулы;
- Анизотропия;
- Улучшенная обработка времени жизни TCSPC;
- Язык программирования "STUPSLANG".
Программное обеспечение для флуоресцентной визуализации и корреляции времени жизни SymPhoTime 64 может использоваться во всех приложениях, основанных на сборе конфокальных данных с разрешением по времени, таких как:
- Time-Resolved Fluorescence;
- Fluorescence Lifetime Imaging (FLIM);
- Phosphorescence Lifetime Imaging (PLIM);
- Fluorescence Correlation Spectroscopy (FCS);
- Fluorescence Lifetime Correlation Spectroscopy (FLCS);
- Foerster Resonance Energy Transfer (FRET);
- Stimulated Emission Depletion Microscopy (STED);
- Dual Focus Fluorescence Correlation Spectroscopy (2fFCS);
- Pulsed Interleaved Excitation (PIE);
- Single Molecule Spectroscopy / Detection;
- Pattern Matching Analysis;
- Time-Resolved Photoluminescence (TRPL);
- TRPL Imaging;
- Lanthanide Upconversion;
- Antibunching.
Получение данных
Поддержка модуля TCSPC:
- HydraHarp 400, PicoHarp 300, TimeHarp 260, MultiHarp 150;
- TimeHarp 200 (Только импорт данных).
Поддерживаемые конфигурации:
- MicroTime 200 с 100 x 100 (x 100) мкм или 10×7.5 см пьезо сканер или FLIMbee galvo сканер;
- MicroTime 100 Laser Scanning Microscopes (LSM) от Nikon, Olympus или Zeiss;
- Обособленный модуль TCSPC;
- Дистанционное управление через интерфейс TCP / IP (программная связь с элементами ZEN и NIS).
Маршрутизация: от 1 до 8 детекторов
Режимы измерения: Single point, multi-point, 2D imaging (XY, XZ, YZ), 3D imaging (XYZ), time lapse (XYT), oscilloscope mode для выравнивания
Предварительный просмотр измерений:
- FLIM, FCS, FLCS и FCCS, Time Trace, TCSPC гистограммы;
- Параллельный расчет и отображение до 4 различных предварительных просмотров.
Автоматизированные измерения: Stacks, Time Stacks, Image Stitching, Multi-Point Measurements
Аппаратное управление:
- PDL 828 «Sepia II» laser driver;
- E-710, E-725, E-727 и контроллер сканера широкого диапазона;
- Shutter of MicroTime 200;
- Широкоугольная флуоресцентная камера IDS uEye USB3 в MicroTime 200.
Анализ данных
Основные характеристики:
- Time gating;
- Binning;
- TCSPC Binning;
- TCSPC Fitting (Multi–Exponential Decay (от 1 до 5 экспоненциал), Least–Squares Fitting, MLE Fitting, IRF;
- Reconvolution, Tailfit, Bootstrap анализ ошибок);
- Глобальный анализ кривой фиттинга TCSPC;
- GUI темы.
Обработка изображений:
- FLIM, FLIM-FRET, Intensity FRET, Anisotropy Imaging, (Time-Gated) Fluorescence Intensity Imaging;
- Сравнение шаблонов, быстрое сопоставление шаблонов;
- Регулируемая цветовая гамма;
- Зона интереса (ROI);
- Экспорт бина для векторного анализа (с помощью стороннего программного обеспечения Globals, разработанного Laboratory for Fluorescence Dynamics).
Корреляция:
- FCS, FCCS, FLCS, PIE–FCS;
- STED-FCS, STED-FLCS;
- FCS Fitting (Models: Diffusion Constants, Triplet state, Conformational, Protonation, Gaussian PSF, User-defined models via scripting, Bootstrap error analysis);
- Глобальный анализ;
- Калибровка FCS;
- Antibunching/Coincidence correlation, Total correlation.
FRET:
- PIE (Pulsed Interleaved Excitation);
- Bleedthrough Correction;
- FLIM-FRET.
STED: STED, gatedSTED, STED-FLIM, Pulsed Interleaved STED and Confocal, Resolution estimation
Fluorescence Intensity Traces: Blinking (On/Off Histogramming), Count Rate Histogram (PCH), Burst Size Histogram, Intensity–Gated TCSPC, Fluorescence Lifetime Traces, Lifetime Histogram, BIFL (Burst Integrated Analysis)
Steady–State Anisotropy: Включает объективные поправочные коэффициенты
Экспорт данных форматов: BMP, ASCII, TIFF, BIN
Пользовательские сценарии (STUPSLANG):
- Определяемые пользователем процедуры анализа, Fitting Functions, Multi–Parameter Filtering;
- Control of external hardware via suited interface.
Требуемый процессор ПК: с SSE2 и EMT64 или AMD64 расширение; рекомендуемые: quad–core или лучше
Тактовая частота процессора: 2.2 GHz (или лучше) quad-core CPU
RAM: минимум 4 GB (рекомендуется 16/32 ГБ)
Операционная систему: Windows 10 x64
Дисковое пространство: >= 100 MB (за исключением хранилища данных)
Дисплей: Full HD Display
Модуль защиты (HASP): USB
Fluorescence lifetime-activated droplet sorting in microfluidic chip systems
Hasan S., Geissler D., Wink K., Hagen A., Heiland J.J., Belder D. Lab Chip, Vol.019, p.403-409 (2019)
Reference to: MicroTime 200, Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), PicoHarp 300 Related to: FRET
Counting molecules by photon statistics
Berlage C. Masterarbeit Humboldt-Universität zu Berlin (2018)
Reference to: MicroTime 200, TimeHarp 260, Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), HydraHarp 400
Poulon F., Pallud J., Varlet P., Zanello M., Chretien F., Dezamis E., Abi-Lahoud G., Nataf F., Turak B., Devaux B., Abi Haider D. Scientific Reports, Vol.008, 14888 (2018)
Reference to: SymPhoTime Related to: FLIM
Kim D., Zhang Z., Yong K. Nanoscale, just accepted manuscript (2018)
Reference to: MicroTime 200
Ca2+ and myosin cycle states work as allosteric effectors of troponin activation
Solis C., Kim G.H., Moutsoglou M.E., Robinson J.M. Biophysical Journal (2018)
Reference to: MicroTime 200, SymPhoTime Related to: FLIM
DNA local flexibility dependent assembly of phase separated liquid droplets
Shakya A., King J.T. Biophysical Journal (2018)
Reference to: PicoHarp 300, SymPhoTime
Precision and accuracy of single-molecule FRET measurements—a multi-laboratory benchmark study
Hellenkamp B., Schmid S., Doroshenko O., Opanasyuk O., Kühnemuth R., Rezaei Adariani S., Ambrose B., Aznauryan M., Barth A., Birkedal V., Bowen M.E., Chen H., Cordes T., Eilert T., Fijen C., Gebhardt C., Götz M., Gouridis G., Gratton E., Ha T., Hao P., Hanke C.A., Hartmann A., Hendrix J., Hildebrandt L.L., Hirschfeld V., Hohlbein J., Hua B., Hübner C.G., Kallis E., Kapanidis A.N., Kim J.Y., Krainer G., Lamb D.C., Lee N.K., Lemke E.A., Levesque B., Levitus M., McCann J.J., Naredi-Rainer N., Nettels D., Ngo T., Qiu R., Robb N.C., Röcker C., Sanabria H., Schlierf M., Schröder T., Schuler B., Seidel H., Streit L., Thurn J., Tinnefeld P., Tyagi S., Vandenberk N., Vera A.M., Weninger K.R., Wünsch B., Yanez-Orozco I.S., Michaelis J., Seidel C.A.M., Craggs T.D., Hugel T. Nature Methods, Vol.009, p.669-676 (2018)
Reference to: MicroTime 200, FluoTime 300, Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), HydraHarp 400, LSM Upgrade Kit Related to: FRET, Single Molecule Detection
A fluorescent membrane tension probe
Colom A., Derivery E., Soleimanpour A., Tomba C., Molin M.D., Sakai N., González-Gaitán M., Matile S., Roux A. Nature Chemistry (2018)
Reference to: LSM Upgrade Kit Related to: FLIM
Quantifying protein oligomerization in living cells: a systematic comparison of fluorescent proteins
Dunsing V., Luckner M., Zühlke B., Petazzi R., Herrmann A., Chiantia S. bioRxiv, (preprint) (2018)
Reference to: LSM Upgrade Kit, SPADs, SymPhoTime
Photoluminescence of CdSe/ZnS quantum dots in nematic liquid crystals in electric fields
Kurochkina M.A., Konshina E.A., Khmelevskaia D. Beilstein Journal of Nanotechnology, Vol.009, p.1544-1549 (2018)
Reference to: MicroTime 100